植物源性食品中氯噻啉的测定
SGLC-LC/MS-008
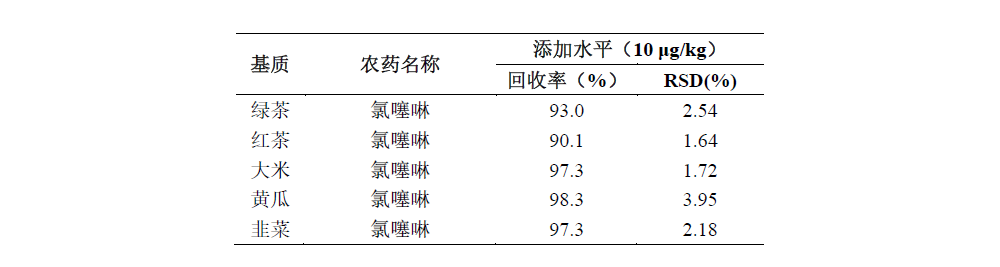
摘要:建立了茶叶、大米、韭菜、黄瓜等植物源性食品中氯噻啉的测定方法。采用岛津的SHINSEN QuEChERS产品对茶叶、大米、韭菜、黄瓜样品进行净化,Shim-pack GIST C18色谱柱进行分离,串联质谱LCMS-8050检测分析。对空白样品10.0 μg/kg浓度加标后,按照上述前处理方法处理后上机,平行5份样品考察回收率和RSD,结果显示:绿茶10.0 μg/kg加标浓度的加标回收率为93.0%,RSD为2.54%;红茶10.0 μg/kg加标浓度的加标回收率为90.1%,RSD为1.64%;大米10.0 μg/kg加标浓度的加标回收率为97.3%,RSD为1.72%;黄瓜10.0 μg/kg加标浓度的加标回收率为98.3%,RSD为3.95%;韭菜10.0 μg/kg加标浓度的加标回收率为97.3%,RSD为2.18%,回收率高,重现性好。该方法适用于植物源性食品中氯噻啉的测定。
关键词:QuEChERS 氯噻啉 植物源性食品 LC-MSMS
1. 实验部分
1.1 实验仪器及耗材
仪器配置:Shimadzu LC-30A 与 LCMS-8050 联用系统;
色谱柱:Shim-pack GIST C18,100×2.1 mm,2 μm (P/N:227-30001-04);
SHINSEN QuEChERS氯化钠提取管(0.5g NaCl,0.2g MgSO4,50 mL离心管,50包&50支,P/N:380-00153);
SHINSEN QuEChERS净化包Ⅰ(2 mL PSA/C18/GCB净化管:50 mg PSA, 50 mg C18,50 mg GCB,150 mg MgSO4,2 mL离心管;P/N 380-00130);
SHINSEN QuEChERS净化包Ⅱ(2 mL PSA净化管:50 mg PSA,150 mg MgSO4,2 mL离心管;P/N 380-00102);
SHINSEN QuEChERS净化包Ⅲ(2 mL PSA/C18净化管:50 mg PSA,50 mg C18,150 mg MgSO4,2 mL离心管;P/N 380-00104);
WondaPak QuEChERS净化包Ⅳ(2 mL PSA /GCB净化管:50 mg PSA,15 mg GCB,150 mg MgSO4,2 mL离心管;P/N 5010-002037);
SHIMSEN Arc Disc HPTFE针式过滤器(P/N:380-00341-05);
LC/MS认证样品瓶LabTotal Vial(P/N:227-34001-01);
SHIMSEN Pipet移液枪:SHIMSEN Pipet PMII-10(P/N:380-00751-02);
SHIMSEN Pipet PMII-100(P/N:380-00751-04);
SHIMSEN Pipet PMII-1000(P/N:380-00751-06)。
1.2 分析条件
UHPLC 条件
色谱柱:Shim-pack GIST C18,100×2.1 mm,2 μm (P/N:227-30001-04)
流 速:0.3 mL/min
进样量:10 μL
柱 温:40 ℃
流动相: A:0.1%甲酸水 B:乙腈
梯度洗脱程序如下:
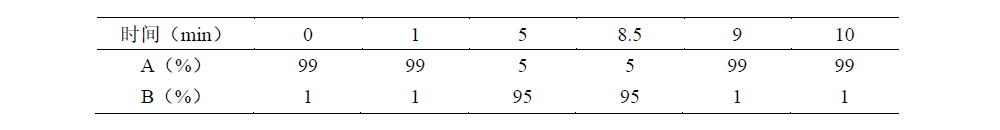 质谱条件
质谱条件
分析仪器: LCMS-8050
离子化模式:ESI,正离子扫描
碰撞气:氩气
雾化气:氮气 3 L/min
接口温度: 300℃
加热模块温度:400 ℃
扫描模式:多反应监测(MRM)
加热气:氮气 10 L/min
干燥气:氮气 10 L/min
DL温度:250 ℃
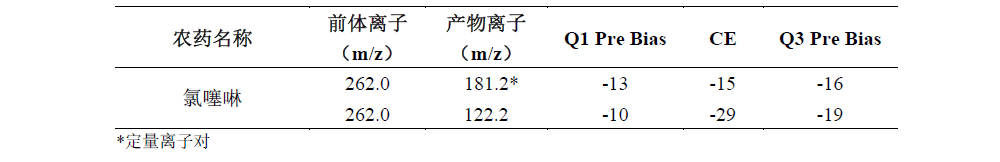
氯噻啉MRM参数见下表1。
1.3 样品前处理
1.3.1 样品提取
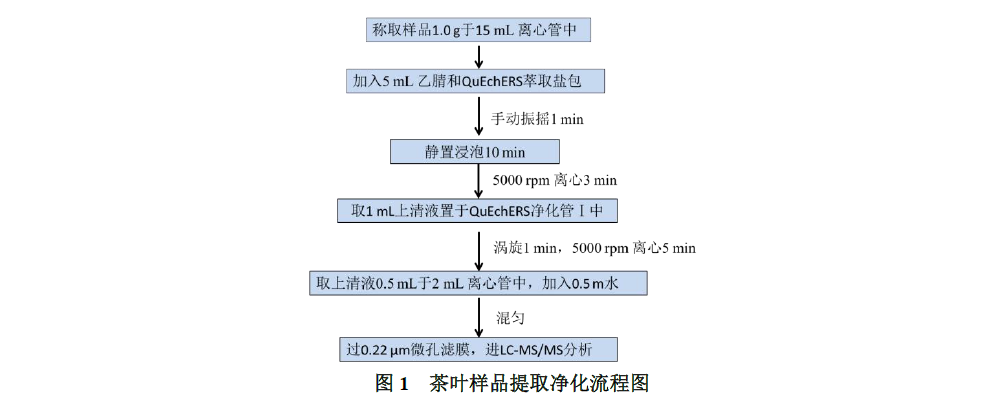
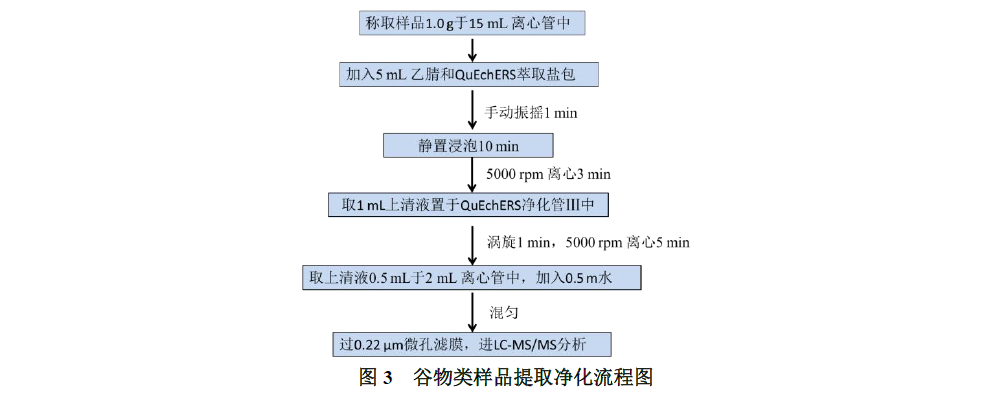
称取1.0 g样品于50 mL离心管中,加入5 mL乙腈和SHINSEN QuEChERS氯化钠萃取盐包(0.5g NaCl,0.2g MgSO4,50 mL离心管,50包&50支,P/N:5010-050026),手动振摇1 min,静置浸泡提取10 min后再手动振摇1 min,5000 r/min离心3 min,取 1mL上清液待净化。流程图见下图1-4。
1.3.2 样品净化
1.3.2.1 茶叶
将1 mL 提取液转移至SHINSEN QuEChERS净化包Ⅰ(2 mL PSA/C18/GCB净化管:50 mg PSA,50 mg C18,50 mg GCB,150 mg MgSO4,2 mL离心管;P/N 5010-015040)中,涡旋混合1 min,5000 rpm下离心5 min,取上清液0.5 mL于2 mL离心管中,加入0.5 mL水,混匀,过0.22 μm微孔滤膜,进LC-MS/MS分析。流程图见下图1。
1.3.2.2 普通蔬菜(黄瓜)
将1 mL 提取液转移至SHINSEN QuEChERS净化包Ⅱ(2 mL PSA净化管:50 mg PSA,150 mg MgSO4,2 mL离心管;P/N 5010-002031)中,涡旋混合1 min,5000 rpm下离心5 min,取上清液0.5 mL于2 mL离心管中,加入0.5 mL水,混匀,过0.22 μm微孔滤膜,进LC-MS/MS分析。流程图见下图2。

1.3.2.3 谷物类(大米)
将1 mL 提取液转移至SHINSEN QuEChERS净化包Ⅲ(2 mL PSA/C18净化管:50 mg PSA,50 mg C18,150 mg MgSO4,2 mL离心管;P/N 5010-002033)中,涡旋混合1 min,5000 rpm下离心5 min,取上清液0.5 mL于2 mL离心管中,加入0.5 mL水,混匀,过0.22 μm微孔滤膜,进LC-MS/MS分析。流程图见下图3。
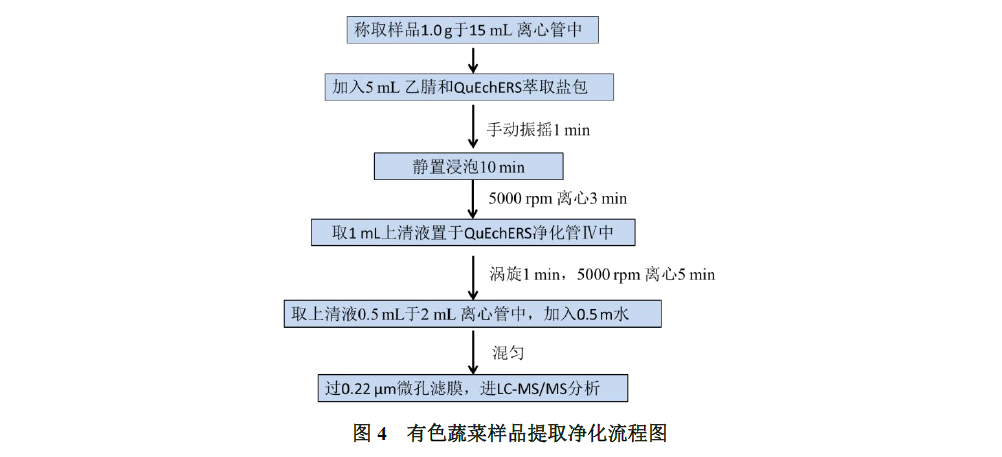
1.3.2.4 有色蔬菜(韭菜)
将1 mL 提取液转移至SHINSEN QuEChERS净化包Ⅳ(2 mL PSA /GCB净化管:50 mg PSA,15 mg GCB,150 mg MgSO4,2 mL离心管;P/N 5010-002037)中,涡旋混合1 min,5000 rpm下离心5 min,取上清液0.5 mL于2 mL离心管中,加入0.5 mL水,混匀,过0.22 μm微孔滤膜,进LC-MS/MS分析。流程图见下图4。
1.4 标准曲线的绘制
取空白样品,按上述1.3.1和1.3.2处理,使用空白基质配制浓度为0.1 μg/L、 0.2 μg/L、 0.5 μg/L、 1μg/L、5 μg/L、10 μg/L、50 μg/L和100 μg/L的不同浓度的标准样品。
2. 结果及讨论
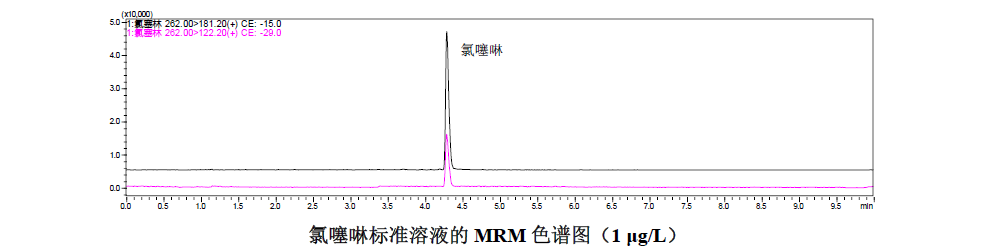
2.1 标准溶液的MRM色谱图
 2.2 线性范围和检出限、定量限
2.2 线性范围和检出限、定量限
取空白溶液配制混合工作液,得到0.1、0.2、0.5、1、5、10、50、100 μg/L不同浓度的样品,按1.2中的分析条件进行测定,外标法定量。以浓度为横坐标,峰面积为纵坐标,绘制校准曲线,如图5~9所示。线性方程、线性范围、相关系数及检出限、定量限结果见表2。


2.3 植物源性食品中氯噻啉的LC-MS/MS检测添加回收结果
将茶叶、大米、黄瓜、韭菜空白样品进行10.0 μg/kg浓度加标后,按照上述前处理方法处理后上机,平行5份样品考察回收率和RSD,具体结果如下:绿茶10.0 μg/kg加标浓度的加标回收率为93.0%,RSD为2.54%;红茶10.0 μg/kg加标浓度的加标回收率为90.1%,RSD为1.64%;大米10.0 μg/kg加标浓度的加标回收率为97.3%,RSD为1.72%;黄瓜10.0 μg/kg加标浓度的加标回收率为98.3%,RSD为3.95%;韭菜10.0 μg/kg加标浓度的加标回收率为97.3%,RSD为2.18%。
3. 结论
综上,本方案采用岛津的SHINSEN QuEChERS产品对茶叶、大米、黄瓜、韭菜等样品进行净化,Shim-pack GIST C18色谱柱进行分离,采用岛津串联质谱LCMS-8050检测分析,建立了茶叶、普通蔬菜、谷物、有色蔬菜等样品中第四类农药氯噻啉的检测方法,该方法操作简单、分析速度快、回收率高、重现性好,适用于植物源性食品中氯噻啉的测定。